Алкены взаимодействуют с металлическим натрием
Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С.
Остановимся на свойствах, способах получения и особенностях строения алкинов.
Химические свойства алкинов
Алкины – непредельные углеводороды, в молекулах которых есть одна тройная связь. Строение и свойства тройной связи определяют характерные химические свойства алкинов. Химические свойства алкинов схожи с химическими свойствами алкенов из-за наличия кратной связи в молекуле.
Для алкинов характерны реакции окисления. Окисление алкенов протекает преимущественно по тройной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Тройная связь состоит из σ-связи и двух π-связей. Сравним характеристики одинарной связи С–С, тройной связи С ≡ С и связи С–Н:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С – С | 348 | 0,154 |
| С ≡ С | 814 | 0,120 |
| С – Н | 435 | 0,107 |
Таким образом, тройная связь С≡С короче, чем одинарная связь С–С , поэтому π-электроны тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью и подвижностью. Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам.
Для алкинов характерны реакции присоединения по тройной связи С ≡ С с разрывом π-связей.
1.1. Гидрирование
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
| Например, при гидрировании бутина-2 в присутствии никеля образуется сначала бутен-2, а затем бутан. |

При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
| Например, при гидрировании бутина-1 в присутствии палладия преимущественно образуется бутен-1. |

1.2. Галогенирование алкинов
Присоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкинами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на тройную связь. |
| Например, при бромировании пропина сначала образуется 1,2-дибромпропен, а затем — 1,1,2,2-тетрабромпропан. |


Аналогично алкины реагируют с хлором, но обесцвечивания хлорной воды при этом не происходит, потому что хлорная вода и так бесцветная)
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
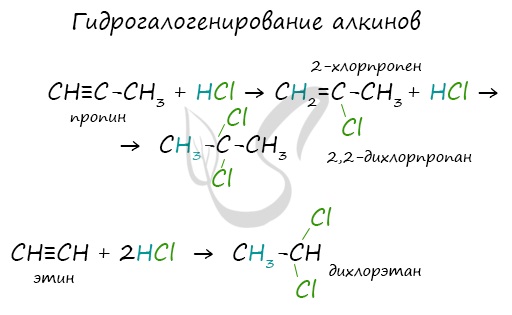
1.3. Гидрогалогенирование алкинов
Алкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или дигалогеналкана.
| Например, при взаимодействии ацетилена с хлороводородом образуется хлорэтен, а затем 1,1-дихлорэтан. |
При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как правило, один продукт реакции, где оба галогена находятся у одного атома С.
При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкинам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропину преимущественно образуется 2-хлорпропен. |

1.4. Гидратация алкинов
Гидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II).
Сначала образуется неустойчивый алкеновый спирт, который затем изомеризуется в альдегид или кетон.
| Например, при взаимодействии ацетилена с водой в присутствии сульфата ртути образуется уксусный альдегид. |

Гидратация алкинов протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов присоединение воды преимущественно по правилу Марковникова.
| Например, при гидратации пропина образуется пропанон (ацентон). |

1.5. Димеризация, тримеризация и полимеризация
Присоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного раствора хлорида меди (I). При этом образуется винилацетилен:

Тримеризация ацетилена (присоединение трех молекул друг к другу) протекает под действием температуры, давления и в присутствии активированного угля с образованием бензола (реакция Зелинского):

Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации ацетилена образуется полимер линейного или циклического строения. |
… –CH=CH–CH=CH–CH=CH–…
2. Окисление алкинов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
2.1. Горение алкинов
Алкины, как и прочие углеводороды, горят с образованием углекислого газа и воды.
Уравнение сгорания алкинов в общем виде:
| Например, уравнение сгорания пропина: |
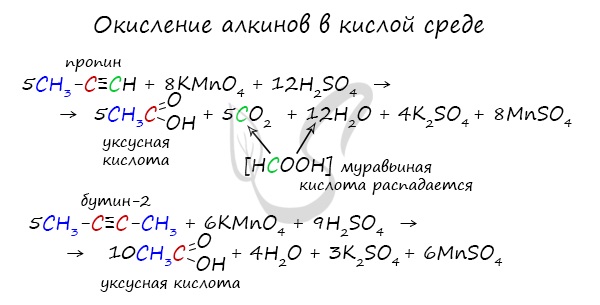
2.2. Окисление алкинов сильными окислителями
Алкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом происходит окисление тройной связи С≡С и связей С-Н у атомов углерода при тройной связи. При этом образуются связи с кислородом.
При окислении трех связей у атома углерода в кислой среде образуется карбоксильная группа СООН, четырех — углекислый газ СО2. В нейтральной среде — соль карбоновой кислоты и карбонат (гидрокарбонат) соответственно.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| R-C ≡ | R-COOH | -COOMe |
| CH ≡ | CO2 | Me2CO3 (MeHCO3) |
При окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C ≡ , поэтому образуется уксусная кислота:

При окислении 3-метилпентина-1 перманганатом калия в серной кислоте окислению подвергаются фрагменты R–C и H–C , поэтому образуются карбоновая кислота и углекислый газ:

При окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ) могут реагировать с образующейся в растворе щелочью в соотношении, которое определяется электронным балансом с образованием соответствующих солей.
| Например, при окислении бутина-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента R–C ≡ , поэтому образуется соль уксусной кислоты – ацетат калия |

Аналогичные органические продукты образуются при взаимодействии алкинов с хроматами или дихроматами.
Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота:

В нейтральной среде образуется соль щавелевой кислоты – оксалат калия:

Обесцвечивание раствора перманганата калия — качественная реакция на тройную связь.
3. Кислотные свойства алкинов
Связь атома углерода при тройной связи (атома углерода в sp-гибридизованном состоянии) с водородом значительно более полярная. чем связь С–Н атома углерода при двойной или одинарной связи (в sp 2 и sp 3 -гибридном состоянии соответственно). Это обусловлено большим вкладом s-орбитали в гибридизованное состояние.
| Гибридизация: | sp | sp 2 | sp 3 |
| Число s-орбиталей | 1 | 1 | 1 |
| Число p-орбиталей | 1 | 2 | 3 |
| Доля s-орбитали | 50% | 33% | 25% |
Повышенная полярность связи С–Н у атомов углерода при тройной связи в алкинах приводит к возможности отщепления протона Н + , т.е. приводит к появлению у алкинов с тройной связью на конце молекулы (алкинов-1) кислотных свойств.
| Ацетилен и его гомологи с тройной связью на конце молекулы R–C ≡ C–H проявляют слабые кислотные свойства, атомы водорода на конце молекулы могут легко замещаться на атомы металлов. |
Алкины с тройной связью на конце молекулы взаимодействуют с активными металлами, гидридами, амидами металлов и т.д.
| Например, ацетилен взаимодействует с натрием с образованием ацетиленида натрия. |
| Например, пропин взаимодействует с амидом натрия с образованием пропинида натрия. |
Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра (I) или аммиачным раствором хлорида меди (I).
При этом образуются нерастворимые в воде ацетилениды серебра или меди (I):

| Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра или аммиачным раствором хлорида меди (I) с образованием белого или красно-коричневого осадка соответственно. Это качественная реакция на алкины с тройной связью на конце молекулы. |
Соответственно, алкины, в которых тройная связь расположена не на конце молекулы, не реагируют с аммиачными растворами оксида серебра или хлорида меди (I).
Химические свойства алкенов
Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
Химические свойства алкенов
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
| Например, при гидрировании бутена-2 образуется бутан. |

| Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление. |
1.2. Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан. |


1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
| Например, при взаимодействии этилена с бромоводородом образуется бромэтан. |
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. |
1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
| Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2. |

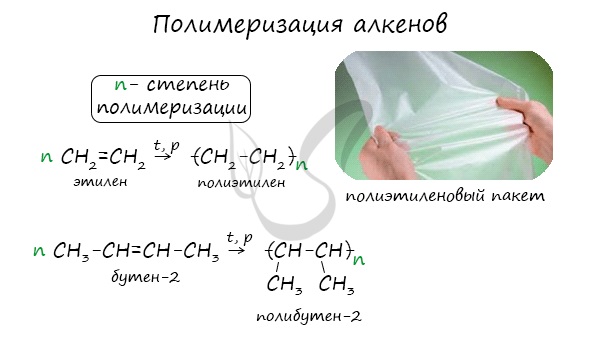
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
| Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен. |

2. Окисление алкенов
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
| Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида) |

| Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида |

2.2. Мягкое окисление
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).

| Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2) |

2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:

При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:

При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
| Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия: |

| Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон: |

Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
| Например, уравнение сгорания пропилена: |
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.

При взаимодействии алкенов с хлором или бромом при нагревании до 500 о С или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
| Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1 |

4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола).
Алканами (парафинами) называют нециклические углеводороды, в молекулах которых все атомы углерода соединены только одинарными связями. Другими словами в молекулах алканов отсутствуют кратные — двойные или тройные связи. Фактически алканы являются углеводородами, содержащими максимально возможное количество атомов водорода, в связи с чем их называют предельным (насыщенными).
Ввиду насыщенности, алканы не могут вступать в реакции присоединения.
Поскольку атомы углерода и водорода имеют довольно близкие электроотрицательности, это приводит к тому, что связи С-Н в их молекулах крайне малополярны. В связи с этим для алканов более характерны реакции протекающие по механизму радикального замещения, обозначаемого символом SR.
1. Реакции замещения
В реакциях данного типа происходит разрыв связей углерод-водород
Галогенирование
Алканы реагируют с галогенами (хлором и бромом) под действием ультрафиолетового света или при сильном нагревании. При этом образуется смесь галогенпроизводных с различной степенью замещения атомов водорода — моно-, ди- три- и т.д. галогенозамещенных алканов.
На примере метана это выглядит следующим образом:
Меняя соотношение галоген/метан в реакционной смеси можно добиться того, что в составе продуктов будет преобладать какое-либо конкретное галогенпроизводное метана.
Механизм реакции
Разберем механизм реакции свободнорадикального замещения на примере взаимодействия метана и хлора. Он состоит из трех стадий:
- инициирование (или зарождение цепи) — процесс образования свободных радикалов под действии энергии извне – облучения УФ-светом или нагревания. На этой стадии молекула хлора претерпевает гомолитический разрыв связи Cl-Cl c образованием свободных радикалов:
Свободными радикалами, как можно видеть из рисунка выше, называют атомы или группы атомов с одним или несколькими неспаренными электронами (Сl•, •Н, •СН3,•СН2• и т.д.);
2. Развитие цепи
Эта стадия заключается во взаимодействии активных свободных радикалов с неактивными молекулами. При этом образуются новые радикалы. В частности, при действии радикалов хлора на молекулы алкана, образуется алкильный радикал и хлороводород. В свою очередь, алкильный радикал, сталкиваясь с молекулами хлора, образует хлорпроизводное и новый радикал хлора:
3) Обрыв (гибель) цепи:
Происходит в результате рекомбинации двух радикалов друг с другом в неактивные молекулы:
2. Реакции окисления
В обычных условиях алканы инертны по отношению к таким сильным окислителям, как концентрированная серная и азотная кислоты, перманганат и дихромат калия (КMnО4, К2Cr2О7).
Горение в кислороде
А) полное сгорание при избытке кислорода. Приводит к образованию углекислого газа и воды:
Б) неполное сгорание при недостатке кислорода:
Каталитическое окисление кислородом
В результате нагревания алканов с кислородом (~200 о С) в присутствии катализаторов, из них может быть получено большое разнообразие органических продуктов: альдегиды, кетоны, спирты, карбоновые кислоты.
Например, метан, в зависимости природы катализатора, может быть окислен в метиловый спирт, формальдегид или муравьиную кислоту:
3. Термические превращения алканов
Крекинг
Крекинг (от англ. to crack — рвать) — это химический процесс протекающий при высокой температуре, в результате которого происходит разрыв углеродного скелета молекул алканов с образованием молекул алкенов и алканов с обладающих меньшими молекулярными массами по сравнению с исходными алканами. Например:
Крекинг бывает термический и каталитический. Для осуществления каталитического крекинга, благодаря использованию катализаторов, используют заметно меньшие температуры по сравнению с термическим крекингом.
Дегидрирование
Отщепление водорода происходит в результате разрыва связей С—Н; осуществляется в присутствии катализаторов при повышенных температурах. При дегидрировании метана образуется ацетилен:
Нагревание метана до 1200 °С приводит к его разложению на простые вещества:
При дегидрировании остальных алканов образуются алкены:
При дегидрировании н-бутана образуются бутен-1 и бутен-2 (последний в виде цис- и транс-изомеров):
Дегидроциклизация
Изомеризация
Химические свойства циклоалканов
Химические свойства циклоалканов с числом атомов углерода в циклах больше четырех, в целом практически идентичны свойствам алканов. Для циклопропана и циклобутана, как ни странно, характерны реакции присоединения. Это обусловлено большим напряжением внутри цикла, которое приводит к тому, что данные циклы стремятся разорваться. Так циклопропан и циклобутан легко присоединяют бром, водород или хлороводород:
1. Реакции присоединения
Поскольку двойная связь в молекулах алкенов состоит из одной прочной сигма- и одной слабой пи-связи, они являются довольно активными соединениями, которые легко вступаю в реакции присоединения. В такие реакции алкены часто вступают даже в мягких условиях — на холоду, в водных растворах и органических растворителях.
Гидрирование алкенов
Алкены способны присоединять водород в присутствии катализаторов (платина, палладий, никель):
Гидрирование алкенов легко протекает даже при обычном давлении и незначительном нагревании. Интересен тот факт, что для дегидрирования алканов до алкенов могут использоваться те же катализаторы, только процесс дегидрирования протекает при более высокой температуре и меньшем давлении.
Алкены легко вступаю в реакцию присоединения с бромом как в водном растворе, так и с органических растворителях. В результате взаимодействия изначально желтые растворы брома теряют свою окраску, т.е. обесцвечиваются.
Гидрогалогенирование
Как нетрудно заметить, присоединение галогеноводорода к молекуле несимметричного алкена должно, теоретически, приводить к смеси двух изомеров. Например, при присоединении бромоводорода к пропену должны были бы получаться продукты:
Тем не менее в отсутствие специфических условий (например, наличие пероксидов в реакционной смеси) присоединение молекулы галогеноводорода будет происходить строго селективно в соответствии с правилом Марковникова:
Присоединении галогеноводорода к алкену происходит таким образом, что водород присоединяется к атому углерода с большим числом атомов водорода (более гидрированному), а галоген — к атому углерода с меньшим числом атомов водорода (менее гидрированному).
Гидратация
Данная реакция приводит к образованию спиртов, и также протекает в соответствии с правилом Марковникова:
Как легко догадаться, по причине того, что присоединение воды к молекуле алкена происходит согласно правилу Марковникова, образование первичного спирта возможно только в случае гидратации этилена:
Именно по такой реакции проводят основное количество этилового спирта в крупнотоннажной промышленности.
Полимеризация
Специфическим случаем реакции присоединения можно реакцию полимеризации, которая в отличие от галогенирования, гидрогалогенирования и гадратации, протекает про свободно-радикальному механизму:
Реакции окисления
Как и все остальные углеводороды, алкены легко сгорают в кислороде с образованием углекислого газа и воды. Уравнение горения алкенов в избытке кислорода имеет вид:
В отличие от алканов алкены легко окисляются. При действии на алкены водного раствора KMnO4 обесцвечивание, что является качественной реакцией на двойные и тройные CC связи в молекулах органических веществ.
Окисление алкенов перманганатом калия в нейтральном или слабощелочном растворе приводит к образованию диолов (двухатомных спиртов):
В кислой среде происходит полное разрыв двойной связи с превращение атомов углерода образовывавших двойная связь в карбоксильные группы:
В случае, если двойная С=С связь находится в конце молекулы алкена, то в качестве продукта окисления крайнего углеродного атома при двойной связи образуется углекислый газ. Связано это с тем, что промежуточный продукт окисления – муравьиная кислота легко сама окисляется в избытке окислителя:
При окислении алкенов, в которых атом C при двойной связи содержит два углеводородных заместителя, образуется кетон. Например, при окислении 2-метилбутена-2 образуется ацетон и уксусная кислота.
Окисление алкенов, при котором происходит разрыв углеродного скелета по двойной связи используется для установления их структуры.
Химические свойства алкадиенов
Реакции присоединения
Например, присоединение галогенов:
Бромная вода обесцвечивается.
В обычных условиях присоединение атомов галогена происходит по концам молекулы бутадиена-1,3, при этом π-связи разрываются, к крайним атомам углерода присоединяются атомы брома, а свободные валентности образуют новую π-связь. Таким образом, как бы происходит «перемещение» двойной связи. При избытке брома может быть присоединена еще одна его молекула по месту образовавшейся двойной связи.
Реакции полимеризации
Химические свойства алкинов
Алкины являются ненасыщенными (непредельными) углеводородами в связи с чем способны вступать в реакции присоединения. Среди реакци присоединения для алкинов наиболее распространено электрофильное присоединение.
Галогенирование
Поскольку тройная связь молекул алкинов состоит из одной более прочной сигма-связи и двух менее прочных пи-связей они способны присоединять как одну, так и две молекулы галогена. Присоединение одной молекулой алкина двух молекул галогена протекает по электрофильному механизму последовательно в две стадии:
Гидрогалогенирование
Присоединение молекул галогеноводорода, также протекает по электрофильному механизму и в две стадии. В обоих стадиях присоединение идет в соответствии с правилом Марковникова:
Присоединение воды к алкинами происходит в присутсвии солей рути в кислой среде и называется реакцией Кучерова.
В результате гидратации присоединения воды к ацетилену ообразуется ацетальдегид (укусный альдегид):
Для гомологов ацетилена присоединение воды приводит к образованию кетонов:
Гидрирование алкинов
Алкины реагируют с водородом в две ступени. В качестве катализаторов используют такие металлы как платина, палладий, никель:
Тримеризация алкинов
При пропускании ацетилена над активированным углем при высокой температуре из него образуется смесь различных продуктов, основным из которых является бензол – продукт тримеризации ацетилена:
Димеризация алкинов
Также ацетилен вступать в реакцию димеризации. Процесс протекает в присутствии солей меди как катализаторов:
Окисление алкинов
Алкины сгорают в кислороде:
Взаимодействие алкинов с основаниями
Алкины с тройной C≡C на конце молекулы, в отличие от остальных алкинов, способны вступать в реакции, в которых атом водорода при тройной связи замещается металл. Например, ацетилен реагирует с амидом натрия в жидком аммиаке:
а также с аммиачным раствором оксида серебра, образуя нерастворимые солеподобные вещества называемые ацетиленидами:
Благодаря такой реакции можно распознать алкины с концевой тройной связью, а также выделить такой алкин из смеси с другими алкинами.
Следует отметить, что все ацетилениды серебра и меди являются взрывоопасными веществами.
Ацетилениды способны реагировать с галогенпроизводными, что используется при синтезе более сложных органических соединений с тройной связью:
Химические свойства ароматических углеводородов
Ароматический характер связи влияет на химические свойства бензолов и других ароматических углеводородов.
Единая 6пи–электронная система намного более устойчива, чем обычные пи-связи. Поэтому для ароматических углеводородов более характерны реакции замещения, а не присоединения. В реакции замещения арены вступают по электрофильному механизму.
Реакции замещения
Нитрование
Лучше всего реакция нитрования протекает под действием не чистой азотной кислоты, а ее смеси с концентрированной серной кислотой, так называемой нитрующей смеси:
Алкилирование
Реакция при которой один из атомов водорода при ароматическом ядре замещается на углеводородный радикал:
Также вместо галогенпроизводных алканов можно использовать алкены. В качестве катализаторов можно использовать галогениды алюминия, трехвалентного железа или неорганические кислоты.
Реакции присоединения
Гидрирование
Присоединение хлора
Протекает по радикальному механизму при интенсивном облучении ультрафиолетовым светом:
Подобным образом реакция может протекать только с хлором.
Реакции окисления
Горение
Неполное окисление
Бензольное кольцо устойчиво к действию таких окислителей как KMnO4 и K2Cr2O7. Реакция не идет.
Деление заместителей в бензольном кольце на два типа:
Рассмотрим химические свойства гомологов бензола на примере толуола.
Химические свойства толуола
Молекулу толуола можно рассматривать, как состоящую из фрагментов молекул бензола и метана. Поэтому логично предположить, что химические свойства толуола должны в какой-то мере сочетать химические свойства этих двух веществ, взятых по отдельности. В частности, именно это и наблюдается при его галогенировании. Мы уже знаем, что бензол вступает в реакцию замещения с хлором по электрофильному механизму, и для осуществления данной реакции необходимо использовать катализаторы (галогениды алюминия или трехвалентного железа). В то же время метан так же способен реагировать с хлором, но уже по свободно-радикальному механизму, для чего требуется облучение исходной реакционной смеси УФ-светом. Толуол, в зависимости от того, в каких условиях подвергается хлорированию, способен дать либо продукты замещения атомов водорода в бензольном кольце – для это нужно использовать те же условия что и при хлорировании бензола, либо продукты замещения атомов водорода в метильном радикале, если на него, как и на метан действовать хлором при облучении ультрафиолетом:
Как можно заметить хлорирование толуола в присутствии хлорида алюминия привело к двум разным продуктам – орто- и пара-хлортолуолу. Это обусловлено тем, что метильный радикал является заместителем I рода.
Если хлорирование толуола в присутсвии AlCl3 проводить в избытке хлора, возможно образование трихлорзамещенного толуола:
Аналогично при хлорировании толуола на свету при большем соотношении хлор/толуол можно получить дихлорметилбензол или трихлорметилбензол:
Замещение атомов водорода на нитрогруппу при нитровании толуола смесью концентрированных азотной и серной кислот приводит к продуктам замещения в ароматическом ядре, а не метильном радикале:
Как уже было сказано, метильный радикал является ориентантом I рода, поэтому его алкилирование по Фриделю-Крафтсу приводит продуктам замещения в орто- и пара-положения:
Толуол можно прогидрировать до метилциклогексана при использовании металлических катализаторов (Pt, Pd, Ni):
При действии такого окислителя, как водный раствор перманганата калия окислению подвергается боковая цепь. Ароматическое ядро в таких условиях окислиться не может. При этом в зависимости от pH раствора будет образовываться либо карбоновая кислота, либо ее соль:
Алкены
Алкены - непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда - этилену - CH2=CH2. Общая формула их гомологического ряда - CnH2n.
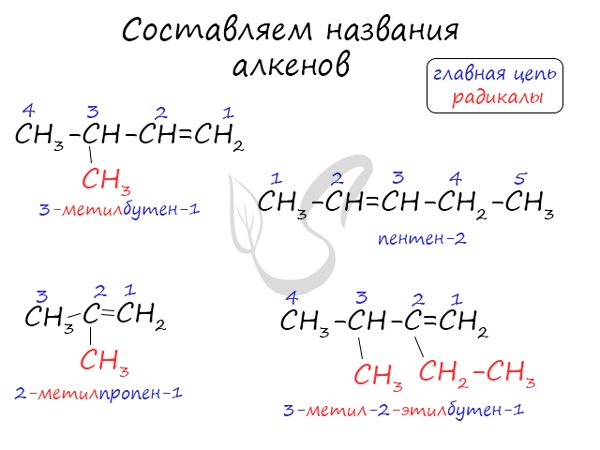
Номенклатура и изомерия алкенов
Названия алкенов формируются путем добавления суффикса "ен" к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
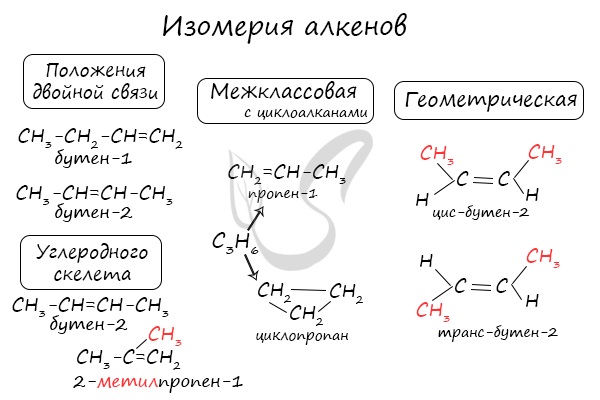
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) - sp 2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
В результате крекинга нефти образуется один алкан и один алкен.
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко водород отдает третичный атом, чуть труднее - вторичный и заметно труднее - первичный.

В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.

В подобных реакциях применяется цинк (цинковая пыль) - двухвалентный металл, который связывает расположенные рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.

При нагревании спиртов c серной кислотой - H2SO4, обладающей выраженными водоотнимающими свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.

Химические свойства алкенов
Алкены - ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).

Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
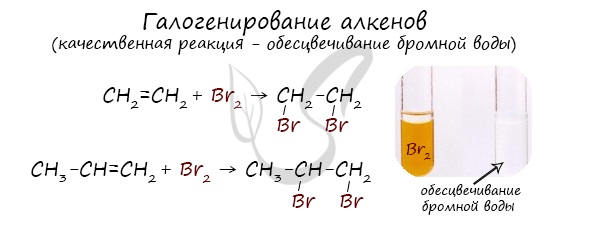
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена - к наименее гидрированному атому углерода.

Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода, гидроксогруппа - к наименее гидрированному.

При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды - полное окисление. При неполном окислении образуются окиси.

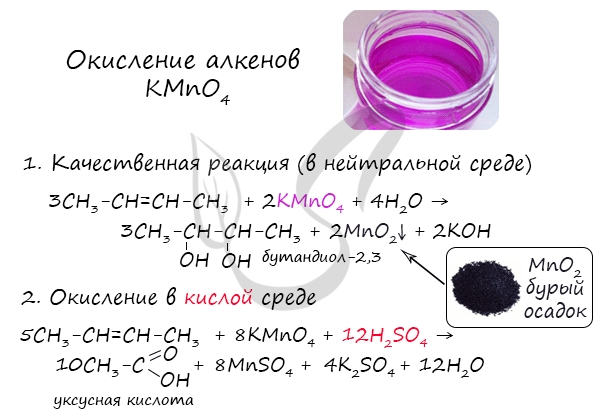
Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета - MnO2.
В более жестких условиях - при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы - двойной связи.
Полимеризация - цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс "n", степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Алкины
Алкины - непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну тройную связь С≡С. Каждая такая связь содержит одну сигма-связь (σ-связь) и две пи-связи (π-связи).
Алкины также называют ацетиленовыми углеводородами. Первый член гомологического ряда - этин - CH≡CH (ацетилен). Общая формула их гомологического ряда - CnH2n-2.
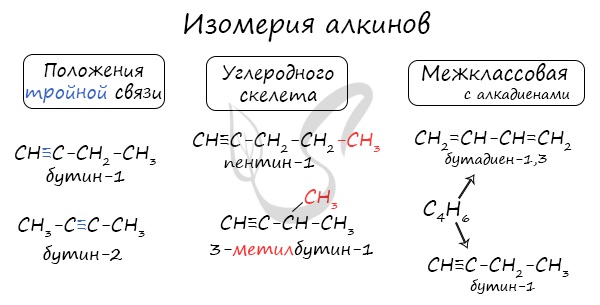
Номенклатура и изомерия алкинов
Названия алкинов формируются путем добавления суффикса "ин" к названию алкана с соответствующим числом: этин, пропин, бутин и т.д.
При составлении названия алкина важно учесть, что главная цепь атомов углерода должна обязательно содержать тройную связь. Нумерация атомов углерода в ней начинается с того края, к которому ближе тройная связь. В конце названия указывают атом углерода у которых начинается тройная связь.

Для алкинов характерна изомерия углеродного скелета, положения тройной связи, межклассовая изомерия с алкадиенами.
Пространственная геометрическая изомерия для них невозможна, ввиду того, что каждый атом углерода, прилежащий к тройной связи, соединен только с одним единственным заместителем.
- В молекулах алкинов присутствуют тройные связи, длина которых составляет 0,121 нм
- Тип гибридизации атомов углерода - sp
- Валентный угол (между химическими связями) составляет 180°
Получение алкинов
При нагревании метана до 1200-1500 °C происходит димеризация молекул метана, в ходе чего отщепляется водород.
Осуществляется напрямую, из простых веществ. Протекает на вольтовой (электрической) дуге, в атмосфере водорода.
2C + H2 → (t, вольтова дуга) CH≡CH
В результате разложения карбида кальция образуется ацетилен и гидроксид кальция II.
Получение гомологов ацетилена возможно в реакциях дегидрогалогенирования дигалогеналканов, в которых атомы галогена расположены у одного атома углерода или у двух соседних атомов.

Химические свойства алкинов
Алкины - ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны.
Водород присоединяется к атомам углерода, образующим тройную связь. Пи-связи (π-связи) рвутся, остается единичная сигма-связь (σ-связь).
CH≡C-CH3 + H2 → (t, Ni) CH2=CH-CH3 (в реакции участвует 1 моль водорода)
CH≡CH + 2H2 → (t, Ni) CH3-CH3 (в реакции участвует 2 моль водорода)

Алкины вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Реакцией Кучерова называют гидратацию ацетиленовых соединений с образованием карбонильных соединений. Открыта русским химиком М.Г. Кучеровым в 1881 году. Катализатор - соли ртути Hg 2+ .
Только в реакции с ацетиленом образуется уксусный альдегид. Во всех остальных реакциях (с гомологами ацетилена) образуются кетоны.

При горении алкины, как и все органические соединения, сгорают с образование углекислого газа и воды - полное окисление.
Сильные окислители (особенно в подкисленной среде) способны разрывать молекулы алкинов в самом слабом месте - в месте тройной связи.
Так, при окислении пропина, образуется уксусная кислота и муравьиная кислота, окисляющаяся до угольной кислоты, которая распадается на углекислый газ и воду.
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород - бензол.

Димеризация ацетилена происходит при наличии катализатора - солей меди I. В результате реакции две молекулы ацетилена соединяются, образуя винилацетилен.
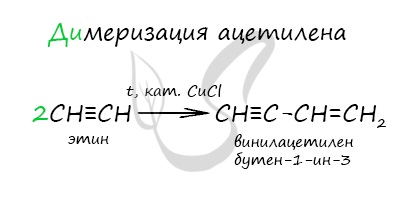
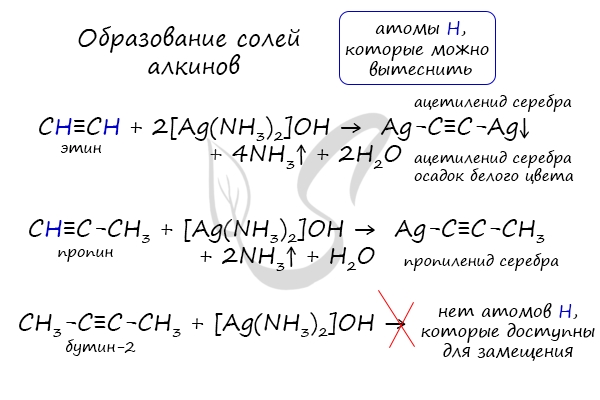
В случае если тройная связь прилежит к краевому атому углерода, то имеющийся у данного атома водород может быть замещен атомом металла. Если тройная связь спрятана внутри молекулы, то образование солей невозможно.
Реакция аммиачного раствора серебра и ацетилена - качественная реакция, в ходе которой выпадает осадок ацетиленида серебра.
Читайте также:
