Активность металлов к кислороду
Химические свойства металлов определяются их активностью. Простые вещества – металлы в химических реакциях всегда являются восстановителями . Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются восстановительные свойства).
Среди металлов традиционно выделяют несколько групп.
благородные металлы (серебро, золото, платина, иридий);
щелочные металлы – I(A) группа ;
щелочноземельные металлы – II(A) группа , кроме Be, Mg.
Металлы встпают в реакции с простыми веществами – неметаллами (кислород, галогены, сера, азот, фосфор и др.) и сложными веществами (вода, кислоты, растворы солей)
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды:
4Li + O 2 = обыч. усл . = 2Li 2 O
2Mg + O 2 = t, °C = 2MgO
Серебро, золото и платина с кислородом не реагируют
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и йодом), образуя галогениды – Ме +n Г -1 n
2Na + Cl 2 = 2NaCl
3. Металлы взаимодействуют с серой, образуя сульфиды.
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
3Na + P = t, °C = Na 3 P
Взаимодействие со сложными веществами
I. Взаимодействие воды с металлами
1). Взаимодействие с самыми активными металлами, находящимися в периодической системе в I(А) и II(А) группах (щелочные и щелочноземельные металлы) и алюминий . В результате образуются основание и газ водород .
Me + H 2 O = Me(OH) n + H 2 (р. замещения)
Внимание! Алюминий и магний ведут себя также:
Магний (в горячей воде):
2) Взаимодействие воды с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.
Металлы средней активности, стоящие в ряду активности до (Н 2 ) – Be, Fe, Pb, Cr, Ni, Mn, Zn – реагируют с образованием оксида металла и водорода
Me + Н 2 О = Ме х О у + Н 2 (р. замещения)
Бериллий с водой образует амфотерный оксид:
Be + H 2 O = t°C = BeO + H 2
Раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe 3 O 4 и водород:
3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H 2 O ≠ нет реакции
II. Взаимодействие растворов кислот с металлами
Металлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот ( раствор азотной кислоты – исключение ), образуя соль и водород.
Кислота (раствор) + Me до (Н2) = Соль + H 2 ↑
III. Взаимодействие кислот-окислителей с металлами
Металлы особо реагируют с серной концентрированной и азотной кислотами:
H 2 SO 4 (конц.) + Me = Сульфат + H 2 O + Х
HNO 3 + Me = Нитрат + H 2 O + Х
4Zn + 10HNO 3 (раствор горячий) = t˚C = 4Zn(NO 3 ) 2 + N 2 O + 5H 2 O
4Zn + 10HNO 3 (оч. разб. горячий) = t˚C = 4Zn(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O
IV. С растворами солей менее активных металлов
Ме + Соль = Новый металл + Новая соль
Активность металла в реакциях с кислотами, водными растворами солей и др. можно определить, используя электрохимический ряд, предложенный в 1865 г русским учёным Н. Н. Бекетовым: от калия к золоту восстановительная способность (способность отдавать электроны) уменьшается, все металлы, стоящие в ряду левее водорода, могут вытеснять его из растворов кислот; медь, серебро, ртуть, платина, золото, расположенные правее, не вытесняют водород.
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Электролиз расплавов и растворов

Электролиз расплавов и растворов встречается в заданиях на ЕГЭ, а значит, если вы планируете сдавать экзамен по химии, эту тему нужно знать на отлично. Наша статья поможет узнать или повторить, что такое электролиз, его правила и схема протекания.
11 класс, ЕГЭ/ОГЭ
Электролиз — это окислительно-восстановительная реакция, которая протекает на электродах и основана на пропускании электрического тока через раствор или расплав.
Не менее важными участниками электролиза являются электроды: катод и анод. Если вы вдруг забыли, что такое катод и анод в химии, напомним.
Катод — это отрицательно заряженный электрод, который притягивает положительно заряженные ионы (катионы). А анод — это положительно заряженный электрод, который притягивает к себе отрицательно заряженные ионы (анионы). Таким образом, на катоде всегда происходит процесс восстановления, а на аноде всегда происходит процесс окисления.
Электроды бывают растворимые и инертные. Растворимые изготавливаются из металлов, например, меди и подвергаются химическим превращениям в ходе электролиза. А вот инертные или нерастворимые электроды не подвергаются химическим превращениям и остаются в неизменном виде как до реакции, так и после нее. Как правило, такие электроды изготавливают из графита или платины.
Виды электролиза
Различают два вида электролиза:
Электролиз водного раствора.
Прежде чем мы рассмотрим каждый процесс отдельно, давай познакомимся с общими для двух видов процессами на электродах.
Процесс на катоде K (−)
Катион принимает электроны и восстанавливается:
Me +n + ne − → Me 0 (восстановление).
Процесс на аноде A (+)
Анион отдает электроны и окисляется:
неMe −n − ne − → неMe 0 (окисление).
Процессы, протекающие при электролизе в общем случае:
К − : Ме +n + ne − → Ме 0 ;
А + : неМе −n − ne − → неМе 0 .
Суммарное уравнение электролиза:

Электролиз расплава
Рассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток.
К − : 2Na + + 2e − = 2Na 0
А + : 2Cl − − 2e − = Cl2
При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны.
Теперь давайте рассмотрим электролиз расплава гидроксида калия.
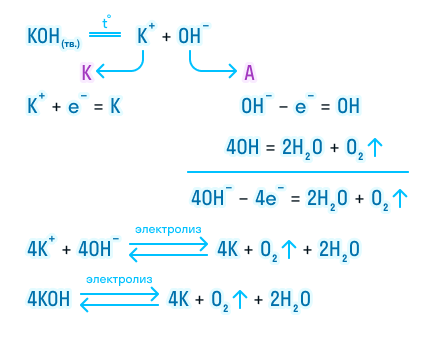
На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды
Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде.
Электролиз раствора
Основным отличием водного раствора от расплава является присутствие молекул воды и ионов H + и OH - как продуктов диссоциации воды. В связи с этим возле катода и анода скапливаются ионы, которые конкурируют как друг с другом, так и с молекулами воды. Рассмотрим электролиз на примере водного раствора KF:
К − : 4H2O + 4e − = 2H2 0 + 4OH −
Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза. Почему так происходит?
Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности.
Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения.

Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла.
Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды. Катионы металла не восстанавливаются, остаются в растворе.
Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды.
Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода.
Для удобства мы собрали информацию об электролизе в таблице:

Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде:

Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде. К тому же процесс на аноде зависит от материала анода и от природы аниона.
Если анод инертный или нерастворимый, то на нем протекают следующие реакции:
При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона.
При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе.
При электролизе растворов щелочей происходит окисление гидроксид-ионов.
Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона.

Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит.
В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов.
В общем виде электролиз солей карбоновых кислот можно записать так:
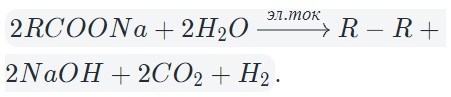
На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала. В катодном пространстве накапливается щелочь.
В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната.
Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.
В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.
Вопросы для самопроверки
1. Выберите верное продолжение фразы «катод — это. »:
Положительно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Положительно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
2. Продолжите фразу «электролиз — это…»:
ОВР с применением тока.
Реакция без изменения степеней окисления с применением тока.
ОВР с применением катализаторов.
3. Как заряжен анион?
Не имеет заряда.
4. Чем отличается электролиз раствора от электролиза расплава?
В расплаве плавится твердое.
Присутствием молекул воды и продуктов ее диссоциации.
5. Если металл стоит в ряду активности металлов между алюминием и водородом, что выделится на катоде?
Электрохимический ряд активности металлов
Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ 0 , отвечающих полуреакции восстановления катиона металла Me n+ : Me n+ + nē → Me
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительные реакциях в водных растворах.
Содержание
История
Последовательность расположения металлов в порядке изменения их химической активности в общих чертах была известна уже алхимикам [1] . Процессы взаимного вытеснения металлов из растворов и их поверхностное осаждение (например, вытеснение серебра и меди из растворов их солей железом) рассматривались как проявление трансмутации элементов.
Поздние алхимики вплотную подошли к пониманию химической стороны взаимного осаждения металлов из их растворов. Так, Ангелус Сала в работе «Anatomia Vitrioli» (1613) пришёл к выводу, что продукты химических реакций состоят из тех же «компонентов», которые содержались в исходных веществах. Впоследствии Роберт Бойль предложил гипотезу о причинах, по которым один металл вытесняет другой из раствора на основе корпускулярных представлений [2] .
В 1793 году Алессандро Вольта, конструируя гальванический элемент («Вольтов столб»), установил относительную активность известных тогда металлов: Zn, Pb, Sn, Fe, Cu, Ag, Au. «Сила» гальванического элемента оказывалась тем больше, чем дальше стояли друг от друга металлы в этом ряду («ряд напряжений»). Однако Вольта не связал этот ряд с химическими свойствами металлов.
В 1798 году Иоганн Вильгельм Риттер указал, что ряд Вольта эквивалентен ряду окисления металлов (т. е. последовательности уменьшения их сродства с кислородом). Таким образом, Риттер высказал гипотезу о возникновении электрического тока вследствие протекания химической реакции [3] .
В эпоху становления классической химии способность элементов вытеснять друг друга из соединений стала важным аспектом понимания реакционной способности. Й. Берцелиус на основе электрохимической теории сродства построил классификацию элементов, разделив их на «металлоиды» (сейчас применяется термин «неметаллы») и «металлы» и поставив между ними водород.
Не отрицая значительных заслуг Бекетова в становлении современных представлений об ряде активности металлов, следует считать ошибочным бытующее в отечественной популярной и учебной литературе представление о нём как единственном создателе этого ряда. [5] [6] .
Многочисленные экспериментальные данные, полученные в конце XIX века, опровергали гипотезу Бекетова. Так, Уильям Одлинг описал множество случаев «обращения активности». Например, медь вытесняет олово из концентрированного подкисленного раствора SnCl2 и свинец — из кислого раствора PbCl2; она же способна к растворению в концентрированной соляной кислоте с выделением водорода. Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора CdCl2.
Бурное развитие теоретической и экспериментальной физической химии указывало на иную причину различий химической активности металлов. С развитием современных представлений электрохимии (главным образом в работах Вальтера Нернста) стало ясно, что эта последовательность соответствует «ряду напряжений» – расположению металлов по значению стандартных электродных потенциалов. Таким образом, вместо качественной характеристики — «склонности» металла и его иона к тем или иным реакциям — Нерст ввёл точную количественную величину, характеризующую способность каждого металла переходить в раствор в виде ионов, а также восстанавливаться из ионов до металла на электроде, а соответствующий ряд получил название ряда стандартных электродных потенциалов.
Теоретические основы
Значения электрохимических потенциалов являются функцией многих переменных и поэтому обнаруживают сложную зависимость от положения металлов в периодической системе. Так, окислительный потенциал катионов растёт с увеличением энергии атомизации металла, с увеличением суммарного потенциала ионизации его атомов и с уменьшением энергии гидратации его катионов.
В самом общем виде ясно, что металлы, находящиеся в начале периодов характеризуются низкими значениями электрохимических потенциалов и занимают места в левой части ряда напряжений. При этом чередование (щелочных и щёлочноземельных металлов отражает явление диагонального сходства. Металлы, расположенные ближе к серединам периодов, характеризуются большими значениями потенциалов и занимают места в правой половине ряда. Последовательное увеличение электрохимического потенциала (от −3,395 В у пары Eu 2+ /Eu [источник не указан 228 дней] до +1,691 В у пары Au + /Au) отражает уменьшение восстановительной активности металлов (свойство отдавать электроны) и усиление окислительной способности их катионов (свойство присоединять электроны). Таким образом, самым сильным восстановителем является металлический европий, а самым сильным окислителем — катионы золота Au + .
В ряд напряжений традиционно включается водород, поскольку практическое измерение электрохимических потенциалов металлов производится с использованием стандартного водородного электрода.
Практическое использование ряда напряжений
Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе:
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно. На данный момент доступна упрощенная авторизация через VK. Здесь вы можете выбрать параметры отображения органических соединений. Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer. Если вы пользуетесь Internet Explorer, смените браузер. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Читайте также:
|

